
Sisältö
Jaksollinen taulukko on jaettu sarakkeisiin ja riveihin. Protonien lukumäärä ytimessä kasvaa, kun luet jaksollista taulukkoa oikealta vasemmalle. Jokainen rivi edustaa energiatasoa. Kunkin sarakkeen elementeillä on samanlaiset ominaisuudet ja sama määrä valenssielektroneja. Valenssielektronit ovat elektronien lukumäärä uloimmalla energiatasolla.
Elektronien lukumäärä
••• Tomasz Wyszoamirski / iStock / Getty ImagesJokaisen energiatason elektronien lukumäärä näytetään jaksotaulukossa. Elementtien lukumäärä kussakin rivissä osoittaa, kuinka monta elektronia kuluu kunkin tason täyttämiseen. Vety ja helium ovat kausitaulukon ensimmäisellä rivillä tai jaksolla. Siksi ensimmäisessä energiatasossa voi olla yhteensä kaksi elektronia. Toisessa energiatasossa voi olla kahdeksan elektronia. Kolmannessa energiatasossa voi olla yhteensä 18 elektronia. Neljännessä energiatasossa voi olla 32 elektronia. Aufbau-periaatteen mukaan elektronit täyttävät ensin alimmat energiatasot ja rakentuvat korkeimmille tasoille vain, jos energiataso ennen sitä on täynnä.
Orbitals


Jokainen energiataso koostuu alueista, joita kutsutaan kiertoradaksi. Kiertorata on todennäköisyysalue, jolla elektronit löytyvät. Jokaisella energiatasolla, ensimmäistä lukuun ottamatta, on useampi kuin yksi kiertorata. Jokaisella kiertoradalla on tietty muoto. Tämän muodon määrää energia, jonka elektronit kiertävät. Elektronit voivat liikkua sattumanvaraisesti mihin tahansa kiertoradan muotoon. Kunkin elementin ominaisuudet määritetään kiertoradalla olevien elektronien avulla.
S-kiertorata
••• Arkeofoto / iStock / Getty ImagesS-kiertorata on muotoiltu palloksi. S-kiertorata on aina ensimmäinen, joka täytetään kussakin energiatasossa. Jaksollisen taulukon kaksi ensimmäistä saraketta tunnetaan s-lohkona. Tämä tarkoittaa, että näiden kahden pylvään valenssielektronit ovat s-kiertoradalla. Ensimmäinen energiataso sisältää vain s-kiertoradan. Esimerkiksi vedyllä on yksi elektroni s-kiertoradalla. Heliumissa on kaksi elektronia s-kiertoradalla, jotka täyttävät energiatason. Koska heliumin energiataso on täytetty kahdella elektronilla, atomi on vakaa eikä reagoi.
P-orbitaali
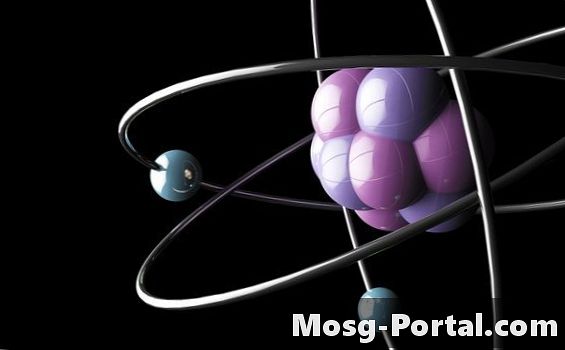
P-kiertorata alkaa täyttyä, kun s-kiertorata on täytetty jokaisella energiatasolla. Energiatasoa kohden on kolme p-orbitaalia, joista kukin on potkurin lavan muotoinen. Jokaisessa p-kiertoradalla on kaksi elektronia, yhteensä kuudelle elektronille p-kiertoradoissa. Hundin säännön mukaan jokaisella p-kiertoradalla energiatasoa kohti on oltava yksi elektroni ennen toisen elektronin ansaitsemista. P-lohko alkaa booria sisältävällä pylväällä ja päättyy jalokaasujen pylvääseen.
D- ja F-kiertoradat

D- ja f-kiertoradat ovat erittäin monimutkaisia. Energiatasoa kohti on viisi d-orbitaalia, alkaen kolmannesta energiatasosta. Siirtymämetallit muodostavat d-kiertoradat. Energiatasoa kohti on seitsemän f-orbitaalia, alkaen viidennestä energiatasosta. Lantanidi ja aktinidi muodostavat f-kiertoradat.