
Sisältö
- TL; DR (liian pitkä; ei lukenut)
- Kuinka laskea moolit
- Muuntaminen Mmoliksi
- Liuoksen keskittyminen
- esimerkki
Yksinkertaisesti laskelmiensa vuoksi kemikit loivat vakioyksikön tietyn reaktiossa tai muussa kemiallisessa prosessissa mukana olevan yhdisteen atomien lukumäärälle. Ne määrittelevät yhden moolin (mol) minkä tahansa aineen määränä, jolla on sama määrä perusyksiköitä kuin 12 grammaa hiili-12: tä, mikä on Avogadros-luku (6,022 × 1023). SI (metrinen) mittausjärjestelmä määrittelee millimoolin (Mmol) tuhatosaa moolia. Yleensä lasketaan aineen moolien lukumäärä punnitsemalla käsilläsi oleva määrä. Jos haluat muuntaa Mmoliksi, kerro 10: llä3 (1,000).
TL; DR (liian pitkä; ei lukenut)
Yksi mooli on yhtä suuri kuin tietyn yhdisteen Avogadros-lukumäärä hiukkasia. Millimooli (Mmol) on tuhatosa moolia.
Kuinka laskea moolit
Atomimassat mitataan atomimassayksiköinä (AMU). Yksi AMU on tarkalleen 1/12 hiili-12-atomin ytimen massasta sen perustilassa. Yksi mooli ainetta on määritelty yhtä suureksi kuin aineen hiukkasten lukumäärä Avogadros. Tämän määritelmän mukaan aineen yhden moolin paino grammoina on sama määrä kuin kyseisen aineen yksittäisen hiukkasen paino AMU: ssa. Esimerkiksi hiili-12: n atomipaino on 12 AMU, joten yksi mooli hiili-12 painaa 12 grammaa.
Harkitse säiliötä, joka on täynnä vetykaasua (H2). Jokainen säiliössä oleva hiukkas on molekyyli, joka koostuu kahdesta vetyatomista, joten sinun on tiedettävä vain vedyn atomimassi molekyylipainon laskemiseksi. Useimmissa jaksollisen taulukon versioissa on lueteltu kunkin elementin atomimassa massan alla. Vedyn, jonka ytimessä on yksi protoni, 1,008 AMU, joka on keskiarvo kaikista luonnossa esiintyvistä vedyn isotoopeista. Siksi vetykaasun atomimassa on 2,016 AMU, ja yksi mooli vetykaasua painaa 2,016 grammaa. Jos haluat löytää näytteessä olevien moolien lukumäärän, punnitse näyte grammoina ja jaa tämä paino vetykaasun moolimassalla grammoina. Esimerkiksi näyte, joka painaa 15 grammaa puhdasta vetykaasua, sisältää 7,44 moolia.
Muuntaminen Mmoliksi
Joskus tutkittavat määrät ovat niin pieniä, että niiden ilmaiseminen moolina on vaivalloista. Syötä millimooli. Kertomalla moolien lukumäärä tuhat, voit muuntaa hyvin pienen määrän hallittavimmaksi. Tämä on erityisen kätevää käsitellessään tilavuusyksiköitä millilitrassa.
1 mooli = 1 000 mmol
Liuoksen keskittyminen
Kemistit käyttävät molaarisuutta mitattuna tietyn yhdisteen pitoisuudesta liuoksessa. Ne määrittelevät molaarisuuden moolien lukumäärä litrassa. Muunat molaarisuuden millimolaarisuuteen kertomalla 1 000. Esimerkiksi 1 moolin (molaarinen, kirjoitettu myös nimellä M) liuoksen pitoisuus on 1 mooli litrassa. Tämä vastaa 1 000 mmol (millimolaarinen, joskus myös kirjoitettu mM) liuosta, joka sisältää 1 000 mmol / l.
esimerkki
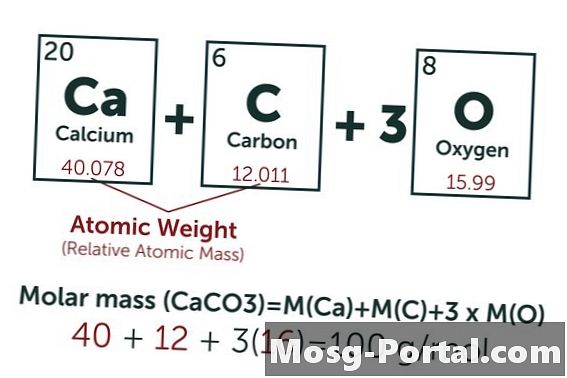
Liuos sisältää 0,15 grammaa kalsiumkarbonaattia. Kuinka monta millimoolia se on?
Kalsiumkarbonaatin kemiallinen kaava on CaCO3. Hiilen (C) atomipaino on noin 12 AMU, hapen (O) noin 16 AMU ja kalsiumin (Ca) noin 40 AMU. Jokainen kalsiumkarbonaattimolekyyli painaa siten 100 AMU, mikä tarkoittaa, että yksi mooli painaa noin 100 grammaa. Paino 0,15 grammaa edustaa 0,15 g - 100 g / mol = 0,0015 moolia. Tämä vastaa 1,5 mmol.
Mikä on tämän paljon kalsiumkarbonaatin molaarisuus ja millimolaarisuus 2,5 litrassa liuosta?
Molaarisuus määritellään moolimääränä litrassa, joten jaa moolien lukumäärä 2,5: llä saadaksesi molaarisuus: 0,0015 ÷ 2,5 =
0,0006 M
Kerro 1000: lla saadaksesi millimolaarisuus =
0,6 mM
Huomaa, että saavutat saman tuloksen millimolaarisuudesta, jos jaat millimoolien määrän liuoksen tilavuudella.