Sisältö
Aineiden kiehumispisteet vaihtelevat niiden rakenteen mukaan molekyylitasolla. Tunnettiin kaikki veden kiehumispiste normaalipaineessa - 100 astetta tai 212 astetta Fahrenheit. Monet aineista, joita ajattelette kaasuiksi, ovat kuitenkin vain kaasuja, koska niiden kiehumispisteet ovat selvästi huoneenlämpötilan alapuolella. Joillakin huoneen lämpötilassa nesteillä, kuten etanolilla, on alhaisemmat kiehumispisteet kuin vedessä.
ilmapiiri
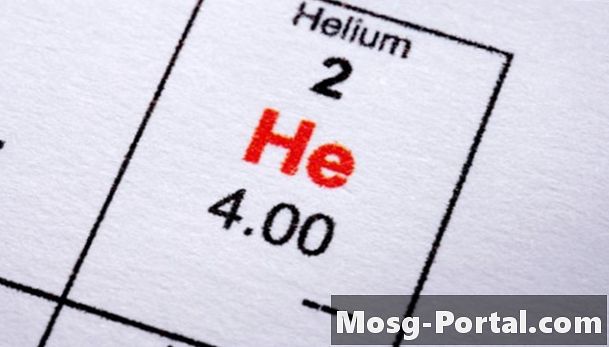
Typpi (N2), hiilidioksidi, happi (O2), helium, kloori (Cl2) ja vety ovat kaikki tuttuja esimerkkejä aineista, jotka kiehuvat paljon alhaisemmissa lämpötiloissa kuin vesi. Nestemäisellä heliumilla on alhaisin kiehumispiste kaikista - noin -452 astetta Fahrenheit, vain 4,2 astetta Celsius-astetta absoluuttisen nollan yläpuolella. Vaikka näitä aineita kutsutaan kaasuiksi, on tärkeää muistaa, että mitään ainetta ei voida määritellä "kaasuksi" tai "nesteeksi" paitsi tietyssä lämpötilassa. Nestemäinen, kiinteä ja kaasu ovat kaikki vain erilaisia ainetiloja, ja aine voi asua missä tahansa näistä kolmesta tilasta lämpötilasta ja paineesta riippuen.
Epäpolaariset hiilivedyt
Vedessä on dipolimomentti, tarkoittaen sen napaista, koska niiden heikko osittainen negatiivinen varaus hapolle ja heikko osittainen positiivinen varaus vedyille. Hiilivetyyhdisteet, kuten bensiinissä, ovat kuitenkin polaarisia. Lontoon dispersiovoimiksi kutsutut vuorovaikutukset pitävät ei-polaarisia molekyylejä yhdessä kiinteässä tai nestemäisessä faasissa; nämä Lontoon voimat vahvistuvat, kun molekyylien koko kasvaa. Tämän seurauksena monet pienemmät ei-polaariset molekyylit, kuten bensiinin komponentit, kiehuvat matalammassa lämpötilassa kuin vesi, koska molekyylien väliset vuorovaikutukset ovat heikompia.
alkoholit
Kuten vesimolekyylit, myös alkoholit ovat polaarisia ja voivat myös muodostaa erityisen sidoksen, jota kutsutaan vety sidokseksi. Vesimolekyylit voivat kuitenkin muodostaa kaksi vety sidosta, kun taas alkoholi voi muodostaa vain yhden. Alkoholien kiehumispiste on yleensä korkeampi kuin samankokoisten hiilivetyjen, mutta alhaisempi kiehumispiste kuin veden. Eli miten teet viinaa kuten viskiä: tislaamalla etanolipitoisuuden lisäämiseksi.
Muut molekyylit
Monilla muilla molekyyleillä on alhaisemmat kiehumispisteet kuin vedessä. Yksi huomattava esimerkki on eetteriksi kutsuttu molekyyliluokka, jolla on happea sitoutuneena kahteen hiiliin; ne ovat hieman polaarisia, mutta eivät yhtä polaarisia kuin vesi tai alkoholit eivätkä pysty muodostamaan vety sidoksia, joten niiden kiehumispisteet ovat yleensä alhaisemmat. Toinen esimerkki on ammoniakki, jota myydään tyypillisesti veteen liuotettuna. Se kiehuu alle 0 celsiusastetta ja huoneenlämpötilassa löydetään kaasuna, tosin sellaisena, joka liukenee helposti.