Sisältö
Atomit ovat pienimpiä hiukkasia, jotka säilyttävät silti elementin kemialliset ominaisuudet. Ne koostuvat subatomisista hiukkasista, joita kutsutaan neutroneiksi, elektroniksi ja protoneiksi. Ionit ovat varautuneita atomeja tai atomiryhmiä. Ionit voivat olla positiivisesti tai negatiivisesti varautuneita. Positiivisesti varautuneita ioneja kutsutaan kationeiksi. Negatiivisesti varautuneita ioneja kutsutaan anioneiksi.
Atomit muodostavat elementit niiden protonien lukumäärän perusteella. Ionivarat osoitetaan ionien lukumäärän perusteella.
Atomi
Elementit ovat atomien perusaineita, joita ei voida kemiallisesti muuttaa tai hajottaa edelleen. Atomit koostuvat ytimen ytimestä ja kiertorataelektroneista. Ydin koostuu protoneista ja neutroneista. Protonit ovat pieniä hiukkasia, joilla on hiukan positiivinen varaus. Neutronit ovat suunnilleen samankokoisia kuin protonit. Heillä ei ole veloitusta. Elektronit ovat hyvin pieniä, jopa pienempiä kuin protonit ja neutronit. Elektroneilla on hiukan negatiivinen varaus. Protonien lukumäärä atomin ytimessä määrää, minkä elementin atom koostuu. Ydin kiertävien elektronien, etenkin valenssielektronien, lukumäärä määrää kuinka reaktiivinen atomi on.
Valenssielektronit
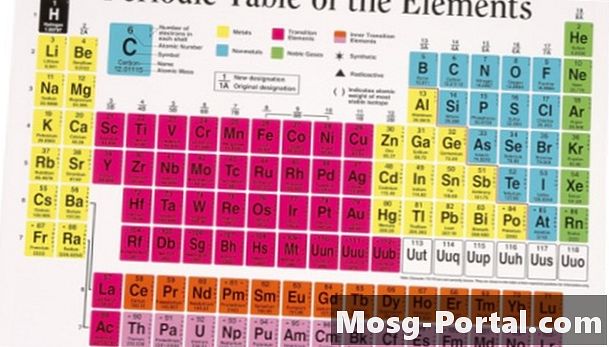
Elektronit kiertävät atomin ytimen, koska niitä houkutellaan positiivisesti varautuneisiin protoneihin. Ne eivät tartu ytimeen, koska ne hylkivät muiden elektronien negatiiviset varaukset. Elektroneilla on taipumus kiertää kerroksissa, joita kutsutaan kuoriksi. Jokainen kuori "täytetään", kun se sisältää kahdeksan elektronin oktetin. Äärimmäisessä kuoressa on valenssielektroneja. Valenssielektronit määrittävät kuinka reaktiivinen elementti on. Eri elementtien atomilla on eri määrä elektronia. Atomin valenssielektronien lukumäärä voidaan määrittää jaksollisen taulukon avulla. Jaksotaulussa on kahdeksan saraketta, ja elementit on järjestetty yhdeksi kahdeksasta sarakkeesta. Elementin valenssielektronien lukumäärä vastaa sen pylväästä, vaihteleen yhdestä kahdeksaan. Kahdeksan sarakkeen jalokaasuissa on täysi valenssielektronien oktettti, eivätkä ne ole kovin reaktiivisia.
Koko oktettit
Jalokaasut ovat erittäin vakaita, koska niillä on täysi ulkokuori. Suurin osa alkuaineista, lukuun ottamatta raskasmetalleja, lantanideja ja aktinideja, noudattaa oktetisääntöä. Oktetisääntö väittää, että elementteillä on taipumus käydä läpi reaktioita, jotka johtavat täydelliseen valenssikuoreen. Atomit, joissa on täydet ulkokuoret, eivät ole kovin reaktiivisia, koska ne ovat energiastabiilia. Atomit vaihtavat elektronia stabiilisuuden lisäämiseksi.
Elektroninsiirto
Ioneja muodostuu, kun atomit siirtävät elektroneja. Kaikki atomit "haluavat", että niiden uloimmassa kuoressa olisi täysi elektroni-oktettti. Atomit, joissa on seitsemän valenssielektronia, haluavat saada yhden elektronin, jolloin niitä olisi yhteensä kahdeksan. Yhden saavuttaminen on helpompaa kuin seitsemän hävittäminen. Atomit, joissa on yksi valenssielektroni, haluavat menettää elektronin pudottuakseen täyteen kuoreen. Yhden menettäminen on helpompaa kuin seitsemän saavuttaminen. Elektroneilla on negatiivinen varaus, joten atomit, jotka saavat elektronin täyttääkseen oktettinsa, myös saavat negatiivisen varauksen ja muuttuvat anioneiksi. Atomit, jotka menettävät elektronin, menettävät negatiivisen varauksen ja muuttuvat kationeiksi. Atomit, jotka menettävät tai saavat useita elektroneja, menettävät tai saavat useita varauksia.